遗传学实验目录
实验一、果蝇的饲养管理、性状观察和性别鉴定
实验二、果蝇杂交实验
实验三、果蝇唾腺染色体的制备与观察
实验四、果蝇酯酶同工的遗传学分析
实验五、小鼠骨髓细胞染色体的制备与观察
实验六、一个拟南芥 InDel 分子标记遗传多态性检测和群体遗传学分析
实验一、果蝇的饲养管理、性状观察和性别鉴定
在遗传学实验中,有许多遗传规律的验证需用果蝇作为实验材料。如分离规律、自由组合规律、伴性遗传规律及连锁呼唤规律的验证。一般进行一个杂交组合,只能验证一个规律。我们这次采用一次杂交设计来完成验证多个遗传规律。
一、实验目的
1、了解果蝇的生命周期,生活习性及饲养管理方法。
2、掌握果蝇一些突变型的性状观察及雌雄性别鉴定的方法。
二、实验原理
黑腹果蝇(Drosophila melanogaster)是被人类研究得最彻底的模式生物之一,果蝇属于昆虫纲、双翅目。作为遗传实验材料有许多优点:
(1) 饲养容易。虫体小,以酵母为食,在饲养瓶中以玉米粉为饲料就可以正常生长繁殖。生活史短。果蝇的生活周期包括:卵-幼虫-蛹-成虫。可在10-14天完成一个世代。
(2) 繁殖率高。雌蝇可以一次产下400个0.5毫米大小的卵。
(3) 染色体数目少。只有4对染色体,约180M。
(4) 唾腺染色体是巨大染色体,是研究染色体畸变和各种基因突变的好材料。
(5) 突变性状多。而且许多性状是容易观察的形态发育上的异常。例如眼色(白眼、
红眼、棒眼、黑眼);翅型(长翅、残翅、小翅、缺刻);体色(灰体、黑檀体、黄体);刚毛(直刚毛、焦刚毛)。
因此,果蝇在遗传学研究中得到广泛应用。
(一) 生活史:
果蝇是完全变态昆虫,它的生活史包括卵、幼虫、蛹及成虫四个发育时期。果蝇生活周期以及各发育阶段的时间长短与温度关系十分密切。超过 30℃,能使果蝇不育和死亡。温度降低,会使果蝇生活周期延长,生活力降低。一般在 20-25℃下培养最为合适。在适宜的温度下,大约经过 10-15 天即可繁殖一代。
(二) 果蝇雌雄辨别
对于同一品系的果蝇,雌果蝇体型较大、腹部末端稍尖、腹背面外观有 5 条黑色条纹,
无性梳,外生殖器外观简单,呈现圆锥状凸起,颜色较浅。而雄果蝇则体型较小、腹部末端顿圆、有性梳、外生殖器外观较复杂,尾部顿而圆,且颜色较深。

雌果蝇 雄果蝇
(三) 常见突变类型
果蝇拥有很多突变类型,且大多肉眼可观,本实验需要观察的果蝇性状如下表所示。
表2-1 需要观察的果蝇性状及具体表型。
器官 |
表型(野生性状/突变性状) |
眼色 |
红眼/白眼 |
体色 |
灰体/黑檀体 |
刚毛 |
直刚毛/焦刚毛 |
翅型 |
长翅/短翅 |
三、实验材料、仪器和试剂
6 号: X 染色体的隐性突变体:灰体、白眼、短翅、焦刚毛
26 号:Ⅲ号染色体隐性突变体:黑檀体、红眼、长翅、直刚毛
(说明:阴影部分为突变性状)
培养箱、麻醉瓶、解剖镜、解剖针、镊子、培养瓶、毛笔、滤纸、白瓷板。
乙醚、玉米粉、琼脂、红糖、酵母粉、丙酸等。
五、 实验步骤
让学生用体视显微镜分别观察已经麻醉致死的不同果蝇品系对应的性状。特别要注意能准确鉴定果蝇的雌雄。通过性梳、尾部黑点和腹部体节(环纹数目)。
性梳:雄性第一对足的跗节基部外侧有黑色鬃毛状性梳,雌性无;
黑点:果蝇尾部有无黑点(雌性腹部尖颜色较浅,雄性腹部尖颜色较深)腹部环纹的数目:雌性果蝇腹部分6节,有7条黑色环纹,雄性只有5节,6条环纹。
六、 注意事项
1.麻醉过度
2.放到培养瓶中时,要先把瓶子倾斜,待果蝇苏醒后再把瓶子竖起来,防止果蝇粘在培养基中而不能苏醒。
3.挑果蝇用毛笔,忌用镊子和其他工具,以免影响果蝇生长繁育。
七、 思考题
1.如何区分雌雄果蝇?
2.果蝇生活经历几个阶段?
附:培养基配制
将 2.5 g 琼脂放在 200 mL 蒸馏水中,煮沸,直到琼脂完全溶解,再加入 22 g 红糖或白糖,调匀,继续加热。另把 28g 玉米粉加入 50 mL 蒸馏水混合后,倒入正在加热的琼脂糖溶液中,并加入溶解在少量体积分数为 95%的酒精溶液中的 0.2 g 苯甲酸,均匀搅拌,煮沸 2~3 min 成糊状,并趁热注入到洁净、干燥、消毒过的培养瓶中,分装 5 个培养基瓶内,使培养基在瓶底的厚度约 3 cm(注意瓶口和瓶壁上不要被培养基沾污)。
水 |
80ml |
玉米粉 |
8.25g |
糖 |
6.2g |
琼脂 |
0.6g |
苯甲酸 |
0.5ml |
酵母 |
少许 |
实验二、果蝇杂交实验
一、实验目的
1、学习果蝇杂交方法。
2、掌握对杂交结果的统计与分析,研究与验证三大遗传规律,并用 X2 检验数据。
二、实验原理
通过果蝇杂交实验可以验证经典遗传学的分离规律、自由组合规律、伴性遗传规律及连锁互换规律。
分离规律:一对等位基因在杂合子中,各自保持其独立性,在配子形成时,彼此分开,随机地进入不同的配子。自由组合规律:支配两对不同性状的等位基因,在杂合状态保持其独立性。在配子形成时,各等位基因彼此独立分离,不同对的基因自由组合。伴性遗传:性染色体所携带的基因在遗传时与性别相联系的遗传方式称为性连锁遗传或伴性遗传。连锁交换规律:位于同一对染色体上的基因联合在一起共同遗传的频率大于重新组合的频率,重组体的产生是由于在配子形成过程中同源染色体的非姐妹染色单体间发生了局部交换。
将两个纯系果蝇亲本进行正反交,获得 F1,根据正反交 F1表型判断哪些性状属于伴性遗传。然后 F1自交,统计 F2数据,分别选取一个单位性状、两个单位性状、三个单位性状进行分离规律、自由组合规律或连锁遗传规律的验证。
三、实验材料、仪器和试剂
果蝇材料:
6 号: X 染色体的隐性突变体:灰体、白眼、短翅、焦刚毛
26 号:Ⅲ号染色体隐性突变体:黑檀体、红眼、长翅、直刚毛说明:阴影部分为突变性状
培养箱、麻醉瓶、解剖镜、解剖针、镊子、培养瓶、毛笔、滤纸、白瓷板、乙醚、玉
米粉、琼脂、红糖、酵母粉、丙酸等。
四、实验步骤
正交:6 ♀ X 26 ♂ 反交:26 ♀ X 6 ♂
选处女果蝇—杂交—去亲本—观察后代—后代自交—移去亲本—观察统计后代—数据处理
1. 挑选处女蝇(由老师提前准备):雌蝇羽化出来 10h 内一般不会交配,选择在这个时间段内收集雌蝇,均属处女蝇。分雌雄分开挑选,具体操作为:用滴有数滴乙醚的棉塞塞住瓶口,平放在桌面上约半分钟,果蝇即被麻醉,分性别装瓶。本实验将 26 号和 6 号果蝇分别培养使其产卵,9-10 天后收集处女蝇(新羽化的雌身体细长,幼嫩的的几乎透明,一般在 8-10h 内没有交配能力,或经过 7-10 天的隔离饲养,没有与任何雄蝇交配过,都属于处女蝇。
2. 杂交:把雌雄果蝇根据实验要求搭配起来,装入一个瓶内,每瓶放 5-6 对,贴上标签,写明组合的亲本、杂交时间、实验者姓名。培养:第二天检查培养瓶,亲本若有死亡,应及时补充,培养瓶放在 25 度恒温箱中培养。注意随时检查培养基是否发霉,如有污染应立即更换新的培养基。
3. 第二周:对果蝇生活史进行细心观察。第一周接种的果蝇,经7-8 天培养后,除亲本(即当瓶壁上出现黑色蛹时除去亲本)。之后将培养瓶继续放在恒温箱中培养再过 3-4 天,F1 成蝇开始出现。接下来的一周将 F1 移入新的培养瓶中进行兄妹交。
4. 第三周,观察记录F1表型。在接种杂交亲本后约 11-12 天,F1 成虫开始羽化,在实验室中取出 F1 成蝇,观察记录其表型和数量。每个杂交组合至少应统计 30 只。F1 兄妹交:取一新培养瓶,放 10-15 对 F1 果蝇进行自交。再过 7-8 天后除去 F1 个体。
5. 第五周,即接种 F1 果蝇 11-12 天后,F2 开始羽化。逐批仔细观察各种表型并计数,
并用 X2 进行测验,说明试验结果是否与理论数值相符合。连续统计 4-5 天,以保证获得足够数量的被观察后代,被观察过的果蝇处死。每组统计 100-200 只。
6. 分别以个人、小组、大组为单位整理数据,计算重组值、并发率,作连锁图。分析总结影响试验结果的因素。
预期结果:
1、分离规律:体色鉴定
黑檀体(ee)× 灰体(EE)→F1 灰体(Ee)→F2 (1:2:1,3:1)
2、自由组合规律:体色与翅形鉴定
黑檀体长翅×灰体短翅→F1 灰体长翅→F2(9:3:3:1)
3、伴性遗传:眼色、性别鉴定
红眼>白眼→F1 无论雌雄均为红眼,F1 雌雄互交,F2 红眼:白眼=3:1,但无白眼雌蝇
五、注意事项
处女蝇的挑选决定着实验的成败,所以一定要分清雌雄。注意乙醚麻醉果蝇时间不要太长,防止果蝇死亡。统计性状时要注意不要重复统计。一定要注意及时按照时间表来去除亲本,防止亲本和后代混杂在一起,影响数据的准确性。雄性果蝇是完全连锁的。
六、思考题
1.为什么一定要挑选处女蝇?
2.在分开饲养的父本和母本中如果混杂了另一性别的果蝇,对父本还是母本的影响更大?
为什么
实验三、果蝇唾腺染色体的制备与观察
一、实验目的
1. 练习分离果蝇幼虫唾腺的技术,学习唾腺染色体的制片方法。
2. 观察了解果蝇唾腺染色体的形态学及遗传学特征。
二、实验原理
本世纪初,D. Kostoff 用压片法首先在果蝇幼虫的唾液腺细胞核中发现了特别巨大的染色体——唾液腺染色体(salivary gland chromosome)。事实上,双翅目昆虫(如摇蚊、果蝇等)的幼虫期都具有很大的唾腺细胞,其中的染色体就是巨大的唾液腺染色体。这些巨大的唾液腺染色体具有许多重要特征,为遗传学研究的许多方面,如染色体结构、化学组成、基因差别表达等提供了独特的研究材料。
双翅目昆虫的整个消化道细胞发育到一定阶段之后就不再进行有丝分裂,而停止在分裂间期。但随着幼虫整体器官以及这些细胞本身体积的增大,细胞核中的染色体,尤其是唾液腺染色体仍不断地进行自我复制而不分开,经过许多次的复制形成约 1000~4000 拷贝的染色体丝,合起来达 5×400 微米长,比普通中期相染色体大得多(约 100~150 倍),所以又称为多线染色体(polytene chromosome)和巨大染色体(giant chromosome)。
唾液腺染色体形成的最初,其同源染色体即处于紧密配对状态,这种状态称为“体细胞联会”。在以后不断的复制中仍不分开,由此成千上万条核蛋白纤维丝合在一起,紧密盘绕。
所以配对的染色体只呈现单倍数。
黑腹果蝇的染色体数为 2n=2×4,其中第 I(X 染色体)染色体为端着丝粒染色体(图21-1),第 II、第 III 染色体为中部着丝粒染色体,形成唾腺染色体时分别出现两条臂,第 IV 为很小的点状染色体。而唾液腺染色体形成时,染色体着丝粒和近着丝粒的异染色质区聚于一起构成一染色中心(chromocenter),所以在光学显微镜下可见从染色体中心处伸出6 条配对的染色体臂,其 5 条为长臂,1 条为紧靠染色中心的很短的臂(第 IV)(图 21-2)。
由于唾腺细胞在果蝇幼虫时期一直处于细胞分裂的间期状态,所以每条核蛋白纤维丝都处于伸展状态,因而不同于一般有丝分裂中期高度螺旋化的染色体。唾腺染色体经染色后,呈现深浅不同,疏密各异的横纹(band)。这些横纹的数目、位置、宽窄及排列顺序都具有种的特异性。研究认为这些横纹与染色体的基因是有一定关系,而一旦染色体上发生了缺失、重复、倒位、易位等,也可较容易地在唾腺染色体上观察识别出来。可见唾腺染色体技术是遗传学研究中一项基本的技术。唾腺染色体的特点:
1、 巨大染色体:5×400 微米,相当于普通染色体的 100-150 倍
2、 多线染色体:果蝇的唾腺细胞停止在分裂间期,染色体核蛋白纤维不断复制,平行排列形成巨大而伸展的多线染色体,染色体经多次复制而不分开,每条染色体大约有 1000-4000 条染色质丝
3、 体细胞联会:体细胞在有丝分裂过程中出现的同源染色体配对现象。由于体细胞同源染色体紧密而精确地配对,它们在全长上几乎完全并行排列,使得果蝇染色体只现二倍体染色体数目的单元数。
4、 横纹结构:间期状态的染色体核蛋白纤维丝处于伸展状态,每条染色体的染色线在不同的区段螺旋化程度不一,经碱性染料染色,出现深浅、疏密各异的横纹。不同染色体的横纹数量、形状和排列顺序是恒定的。利用这些特征不仅可以鉴定不同的染色体,还可以结合遗传试验结果进行基因定位。20 世纪 30 年代,C.B.Bridge 发表首张多线染色体细胞学图谱。横纹的线性排列代表基因的关系,用于染色体结构变异的精细分析,易观察到染色体结构变异,所以唾腺染色体是研究染色体畸变的好材料。
5、 Puff 结构:幼虫的不同发育时期,浓缩的染色质纤维会成群解旋、松开,形成泡状松散结构,使相应的基因得以表达,这种泡状结构称为 Puff 结构,亦称染色体的疏松。
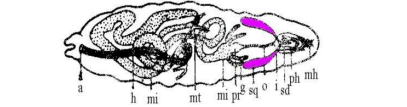
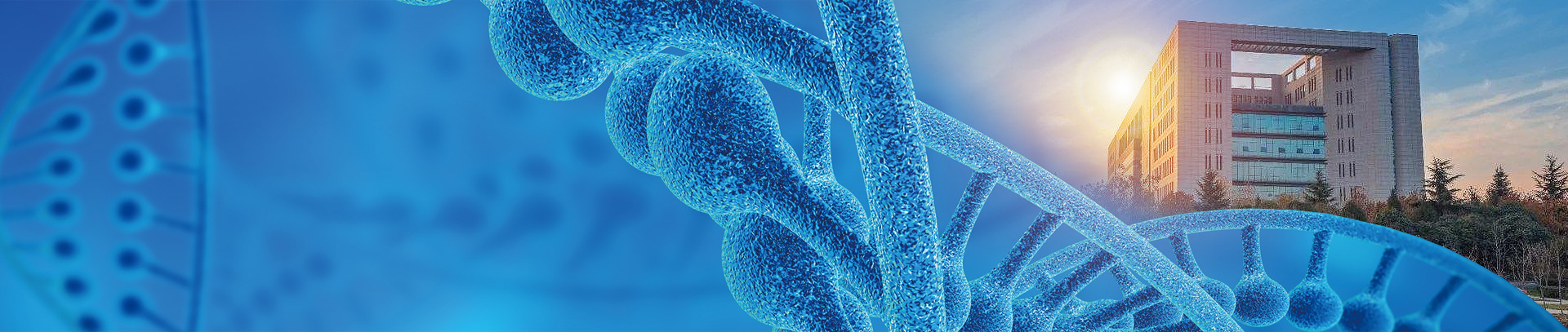
图 1 果蝇唾腺(紫色标注)在虫体的位置。
A:肛门、 h:后肠、g:盲囊、mi:中肠、i:唾腺原基、mh:大腮钩、o:食道、ph:咽头、pr:前胃、 sd:唾腺分泌管、sq;唾腺、mt:马氏管。
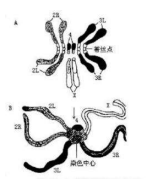
图 2 果蝇唾腺染色体结构图
三、实验材料、仪器和试剂
黑腹果蝇三龄幼虫。
双筒解剖镜、光学显微镜、镊子、小烧杯、解剖针、载玻片、盖玻片、滤纸(吸水纸)。
四、实验步骤
1. 三龄幼虫的饲养和挑选
黑腹果蝇容易饲养,也易获唾腺,但为获得理想的染色体制片标本,需要采用生长良好、形体肥大的三龄幼虫(化蛹前),以保证唾腺发育良好。当幼虫爬上瓶壁准备化蛹即为三龄幼虫,此时虫体肥大,便于解剖,是制备唾腺染色体的最理想时期。实验前可以将幼虫放在 50 ℃水浴锅的盖子上,受热之后幼虫会向瓶口爬去。
2. 幼虫唾腺的分离
(1) 当幼虫爬上瓶壁准备化蛹前即为三龄幼虫,此时虫体肥大,便于解剖,是制备唾腺染色体的最理想时期。取一三龄幼虫置于载玻片上,并加上一滴生理盐水(如幼虫带有饲料可先用生理盐水洗净),置双筒解剖镜下检查。首先熟悉幼虫结构,头部稍尖,并且有一黑点即口器,不时地摆动。
(2) 在解剖镜下用两支解剖针,一针压住头部,压点尽可能靠头部口器处。因为幼虫会蠕动,这一步需先练习几遍。
(3) 幼虫头部固定之后,再用另一针压住尾端(尾端 1/3 处)(或用尖头镊子夹住),平稳快速一拉,使口器部分断开,体内各器官也从切口挤出,一对唾腺也随之而出。唾腺是一对透明的香蕉状腺体,仔细观察可发现由一个个较大的唾腺细胞组成。
(4) 分离的腺体可能伴有消化道和脂肪体。在载玻片上再加一滴生理盐水,确定取得了腺体后,再用刀片或镊子仔细剔除这些杂物,仅让腺体留下,或将腺体吸到干净玻片上。
3. 唾腺染色体的制片和染色
(5) 用滤纸将多余的生理盐水吸去,注意不要碰着腺体,以防吸走。然后滴一滴 1N 的盐酸,浸泡 2-3 分钟,使组织疏松,以便压片时细胞分散,染色体散开。(6)用吸水纸吸去盐酸,加 1 滴蒸馏水,轻轻冲洗后吸干,加 2 滴醋酸洋红或改良品红染色液,染色 5-20 分钟(此过程应保持腺体一直处于染液的浸泡中)。
(6) 染色后,盖上盖玻片,用滤纸轻轻吸去多余染液,然后放平在桌面,用大拇指压下盖片,可横向揉几下(注意不要使盖片滑动,且只朝一个方向揉动,不要来回揉!),多练习几次,可望获得分散良好的制片。
4. 观察结果
果蝇唾腺组织未压片之前染色观察,可在显微镜下观察到被染色成深紫色的细胞核。压片后观察可以看见分散好的一团一团的染色体,而且有5条长臂。
本次实验的难点在于成功分离果蝇唾腺,成功分离的完整的唾腺像是两根香蕉状的组织(图3.3)。压片成功且背景干净的唾腺染色体是清晰的一个中心区域连接着5条长臂(图 3.4)。如果什么也没有染上,则有可能没有分离到唾腺或者是在解离、染色和洗涤过程中丢失了唾腺。如果染色结果是只有一团团的细胞核,则是因为解离不充分或者是压片力道不够。反之如果压片过度则会导致染色体断裂成碎片状态。
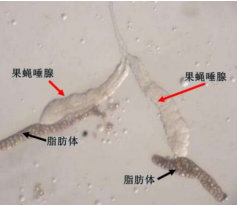
图3 体视镜下观察的唾腺组织
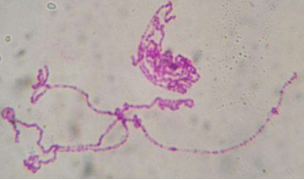
图4 分散较好的唾腺染色体
五、注意事项
本次实验需要将体视镜的底部光源调暗或者关掉下光源。如果拉断了虫体,根据闭合、折光度、无色透明(与水的颜色一样)的特点把唾腺挑取出来。不要把脑、胃等当成唾腺,脑为白色,的唾腺颜色为白色。唾腺是无色透明。HCl 处理后唾腺体积很小,染色时染色液不要过多,以免压片时唾腺随染液流走。果蝇唾腺为单层细胞构成,在解剖和制片过程中注意保湿。六、思考题
1. 唾腺染色体的特征有哪些?
2. 成功解剖唾腺组织的前提是什么?
3. 如果唾腺染色体的压片效果不好,应怎样加以改善?
操作视频可见中国大学 MOOC 网站上北京大学《遗传学实验》实验3和南京大学《遗传学实验》实验8
实验四、果蝇酯酶同工的遗传学分析
一、实验目的
1. 掌握聚丙烯酰胺凝胶电泳分离同工酶的技术。
2. 了解果蝇酯酶同工酶的遗传方式。
二、实验原理
同工酶是指那些催化功能相同,而分子构型不同的酶。酶蛋白分子的不同,反映了为它们编码基因的 DNA 碱基顺序不同。利用凝胶区带电泳可以将不同的同工酶分离,并利用特异底物染色法使它们在凝胶上显示出迁移率不同的活性区带。比较亲代与子代的酶带,就可以对控制它们的基因进行遗传分析。如同其他的形态标记,同工酶作为生化遗传标记已广泛应用于基因作图、发育遗传学、群体遗传学、分类学等多个领域。同工酶电泳分析是一种重要而用途广泛的分子生物学方法。
(polyacrylamide gel electrophoresis,简称 PAGE)聚丙烯酰胺凝胶是由单体丙烯酰胺和交联剂 N,N-甲叉双丙烯酰胺在加速剂四甲基乙二胺 TEMED 和催化剂过硫酸铵的作用下聚合交联成三维网状结构的凝胶,以此凝胶为支持物的电泳称为聚丙烯酰胺凝胶电泳。实验二是用到了 8%的分离胶进行核酸的分离和硝酸银染色,而本次实验进行的是蛋白的分离和底物的显色。二者不同之处在于,分离蛋白时通常需要先进行浓缩胶电泳再进行分离胶电泳。浓缩胶是由较低浓度(通常 5%)的丙烯酰胺构成,当样品经过浓缩胶时由于胶内网孔较分离胶(8%-15%)网孔大,样品的移动速度较快,最终使样品“堆积”在浓缩胶和分离胶之间。当样品进入分离胶时,蛋白质依靠分子筛效应和电荷效应进行分离。
酯酶(Esterase)是催化酯类化合物水解成酸和(-OH)醇或酚的酶系。醋酸萘酯在酯酶的催化下水解产生醋酸和萘酚,萘酚可与坚牢蓝反应生成紫褐色的物质。因此本实验中酯酶同工酶经过非变性丙烯酰胺电泳进行迁移分离后,依然保持活性,在加入染色液后,酯酶将底物醋酸萘酚分解成萘酚,萘酚与染料坚牢蓝 RR 盐反应生成有颜色的物质,指示的位置就是酶带所在的位置,由此鉴别出酶谱的差异,酶带颜色的深浅反映出酶活性的大小。黑腹果蝇 Est-6 基因位于 3 号染色体遗传图谱的 36.8,细胞学分析位于 3L 左臂上的 68F7-F8(唾腺染色体压片中黑腹果蝇的唾腺染色体被 C.B.Bridges 分为 102 个区,这里 Est-6 的编码基因位于第 68 区。前人研究标明 Est-6 主要存在于雄蝇的前射精管中。Est-6 酶带在蛹期和刚羽化的成虫中不显示,因此需要将羽化的成虫再饲养两天以上才能保证有 Est-6 酶带。本实验中黑腹果蝇的酯酶-6(Est-6)酶带有三型,一型是仅有一条迁移率较大的酶带,这种酶带在凝胶上泳动较快,称为 F 带,另一型仅有一条泳动较慢的带,这种酶带称为 S 带,第三型是有两条酶带,一条 F 带和一条 S 带。实质上三种带型的结果是由 Est-6F 与 Est-6S 一对等位基因的组合不同决定的。前二型分别是纯合体 Est-6F/F 和 Est-6S/S,而第三型是杂合体 Est-6F/S。
三、实验材料、仪器和试剂
黑腹果蝇的三个品系:野生型(wildtype)、残翅(vestigialwing)、黑檀体(ebonybodycolor)
1.凝胶组成液:
A. Tris-柠檬酸缓冲液:Tris15 克、柠檬酸 1.25 克用蒸馏水溶解,调 pH=8.9,定容至 1000 毫升。
B. 丙烯酰胺 24 克,用 A 液溶解,定容至 100 毫升。
C. 甲叉双丙烯酰胺 0.75 克,用 A 液溶解,定容至 100 毫升。
D. 乙二胺四乙酸二钠 0.187 克,溶于 15 毫升 A 液中。
E. 四甲基乙烯二胺原液。
F. 过硫酸胺 0.4 克,溶于 10 毫升蒸馏水中。
G. 丙烯酰胺 10 克、甲叉双丙烯酰胺 2.5 克,溶于蒸馏水中,定容至 100 毫升。
2.电极缓冲液:
Tris6.2 克、甘氨酸 2 克,溶于 100 毫升蒸馏水中,pH=8.7,用时稀释 50 倍。
3.样品匀浆液:蔗糖 1.5 克,溴酚蓝 0.01 克,Triton×100 0.05 克溶于 10 毫升蒸馏水中。
以上溶液全部放入冰箱,0—4℃保存。f 液用新鲜配制的或贮存期二周内的。其他溶液均可贮用二个月。
4.染色缓冲液(0.1mol/L 磷酸缓冲液):
14.2 克 Na2HPO4 溶于水中,用 2 mol/LHCl 调 pH 至 6.5,定容至 1000 毫升。
5.底物溶液: α-萘乙酸 1 克、β萘乙酸 0.25 克,溶于 25ml 丙酮内
6.脱色固定液:
水∶甲醇∶冰醋酸=5∶5∶1
四、实验步骤
1.样品处理。
将羽化至少 2 天的成虫接到一只空培养管中,马上放入冰箱冷藏室冷冻 15 min,拿出后马上置于预冷的研磨器中,按样品质量与样品匀浆液体积比 1∶ 8 加入预冷过的样品匀浆液,在冰浴中研磨。匀浆完毕,置离心机中,以 3500 转/分离心三分钟。
2. 聚丙烯酰胺凝胶制备。
A.安装胶板
一个模具可以放置两块胶,分别由一块短玻璃和一块长玻璃匹配夹紧构成一个封闭的
空间。注意根据胶板的厚度提前准备好与之对应的梳子。并检漏,确认不漏再制胶。
B.制备分离胶
吸取 a 液 4.9 mL、b 液 3.75mL、c 液 3.35mL、d 液 0.325mL、e 液 25μL 混匀,加入 f 液 0.125 mL 摇匀,慢慢倒入大小为 16×15×0.1cm 的垂直板电泳槽的二块玻板间。倒入后要求一无气泡、二不渗漏。然后铺上 1-2 厘米高的水层压平,这样凝胶聚合后,面上可呈水平。在室温下经 20 分钟后,凝胶与水层间出现折光不同的界面时,说明凝胶已聚合。倒去水层,用滤纸吸尽余水。该层为分离胶。
C.制备浓缩胶
吸取 a 液 2.95 mL、g 液 1 mL、e 液 5 mL、f 液 0.05 mL,混匀后倒入分离胶上部,然后插上样品梳。过 30 分钟后即聚合,该层为浓缩胶。小心抽出样品梳,这样在浓缩胶面上就留下间隔开的加样槽。用滤纸条吸净加样槽内残存的溶液。上下电泳槽分别注入电极缓冲液。
3.上样和电泳
每个点样孔上 10 μL。在 4℃冰箱内以 150 伏特电压开始电泳,方向从负极到正极。当溴酚蓝进入分离胶后,可将电压提至 200 伏特,大约 2.5 小时后,溴酚蓝到达底部标线处,即可结束电泳。
4.染色和固定
撬开玻璃板,小心取下凝胶,投入染色液中,染色液以染色缓冲液 30 毫升,坚牢蓝 RR10 毫升,底物溶液 1 毫升组成。室温下 5 分钟后酯酶同工酶带已清晰显示,其中紫红色醒目的即为 Est-6 酶带。取出凝胶用水冲净后投入脱色固定液中漂洗过夜。脱去底色后,酶带更为清晰,可制成干片永久保存。可制成干片永久保存,或浸清水内,经常换水,足供一年观察。
5. 观察结果
观察不同亲本的带型是否一样。理论上有三种酯酶类型,Est-6F/F,Est-6S/S 和杂合体Est-6F/S。根据酯酶在蛋白胶上迁移的速率进行区分。
五、注意事项
1. Est-6酶带在蛹期不显示,成虫刚刚羽化时也不显示,所以作电泳分析时,如为新羽化的成虫,应转入另一培养瓶中饲养二天以上,方能清晰地显示 Est-6酶带。
2. 实验过程中注意安全。凡含丙烯酰胺,甲叉双丙烯酰胺的溶液均有神经性毒,慎勿沾于皮肤及粘膜上。因此在制胶之前要进行检漏工作,确保胶板装好不漏的情况下再灌胶。
六、思考题
实验五、小鼠骨髓细胞染色体的制备与观察
一、 实验目的
1. 了解利用动物细胞进行染色体制片的一般方法及其与其他制片方法的区别。
2. 正确掌握细胞收集、低渗、滴片等技术手段。观察和了解小鼠染色体的数目(20 对)及形态特征。
二、 实验原理
1. 每个物种染色体的数目、形态相对稳定,其上的基因决定物种生长发育的全部信息。因此,通过染色体分析,可了解某一物种最基本的遗传指标。在此,优良的染色体标本的制作是前提。
2. 进行染色体标本的制备时,一般取自细胞分裂旺盛的组织,如骨髓、淋巴细胞以及通过人工培养的悬浮液。如将秋水仙素注射到动物的腹腔内,经肠系膜吸收,并可转运到骨髓,结果使正在分裂的细胞不能形成纺锤体,染色体停留在中期状态,经过处理和制片后就可以清楚的观察到染色体。优点是省却了细胞培养,可获得大量分裂的细胞。缺点是:这种方法是属于侵害性的,只适用于动物个体较小、来源丰富的材料。大型动物可骨髓穿刺,例如临床血液疾病的分析。
三、 实验材料、仪器和试剂
1. 低渗液:0.075M KCl。渗透压和离子强度均低于正常细胞生理条件的溶液,例如水、低渗的柠檬酸钠、氯化钠、氯化钾等。其效果取决于低渗液的化学组成、处理温度和时间。原理:凭借反渗透作用,使细胞膨胀,染色体铺展,使粘附于染色体上的核仁物质散开,以便能在一个平面上观察所有染色体形态。
2. 固定液:甲醇:冰醋酸=3:1。特征:迅速穿透细胞,将其固定并维持染色体结构的完整;增强染色体的嗜碱性,有利于染色。单纯的固定液一般难以达到这些要求,因此常用两种混合的固定液。Carrnoy 首次使用甲醇:冰乙酸=3:1(卡诺固定液),临时配置。长期放置影响效果,固定 15-24 分钟。必要时改变二者比例,甲醇:冰乙酸=1:1(冰乙酸比例增加)有利于细胞膨胀,染色体铺开,但易使染色体散失,细胞破裂
3. 秋水仙素:10-30ug/g 体重,处理 2-3 小时。使纺锤体不能形成,从而使染色体停留在中期,否则,就没有那么多的中期染色体存在。因为细胞分裂中期在整个分裂期中占的比例不大。
四、 实验步骤
1. 腹腔注射秋水仙素溶液:在实验前 2-3 小时,对实验用小鼠按 10-30ug/g 体重的量进行
0.4%的秋水仙素注射。
2. 取材:用断颈法处死小鼠,通过解剖取出股骨(可参考人的大腿骨的位置),一定要把肌肉除净。剪开股骨头,曝露出骨髓腔。
3. 用注射器吸取 1ml 2%的柠檬酸钠,反复冲洗骨髓细胞,直至股骨变白。
4. 低渗:加入低渗液,用吸管反复吹打几次,然后把离心管放在37度恒温水浴锅内低渗20 分钟
(使细胞充分吸水膨胀而不破裂,从而使染色体足够分散开,之后经过滴片时的摔打和骤降温过程,使细胞很快破碎,染色体进一步分散开。如果低渗处理不够,在细胞从高处掉下后也无法摔碎,染色体将难以观察。)
5. 固定:加 1ml 固定液,吹打之后放入 37 度水浴锅内固定 10 分钟
6. 制备细胞悬浮液
7. 滴片:从冰箱取出预冷的载玻片,手持吸管在载玻片上方 30-40cm 处向下滴片,每张片上约 2-3 滴,并吹开
8. 干燥:自然干燥
9. 染色
10. 观察
五、注意事项
影响实验结果的重要步骤:
1. 秋水仙素的注射 至关重要
2. 取骨参照人的大腿骨的位置
3. 低渗装片分散不好的主要原因就在低渗上,低渗使细胞充分吸水膨胀而不破裂,一直保持在涨的很大而又不破裂的状态。进而使得细胞内的中期染色体能足够分散开来,从而使经固定等步骤后仍然处于膨胀状态。之后经过滴片时的摔打和骤降温过程,使细胞很快破碎,染色体进一步分散开。如果低渗处理不够,在细胞从高处掉下来也无法摔碎,染色体将难以观察。
4. 滴片越高越好,在我们可以达到的高度范围内,基本不用担心染色体摔碎的问题。
六、思考题
实验六、一个拟南芥 InDel 分子标记遗传多态性检测和群体遗传学分析
一、实验目的
1、了解生物基因组的遗传标记的特点
2、掌握分子标记插入/缺失(InDel)的检测原理和方法
3、掌握 PCR 扩增技术和琼脂糖凝胶分离技术
二、实验原理
InDel 是指在近源种或同一物种不同个体基因之间基因组同一位点的序列发生不同大小核苷酸片段的插入或缺失(insertion-deletion),是同源序列比对产生空位(gap)的现象。
InDel 在基因组中分布广泛、密度大、数目众多。InDel 多态性分子标记是基于插入/缺失位点两侧的序列设计特异引物进行 PCR 扩增的标记,具备共显性遗传特征,其本质仍属于长度多态性标记,可利用便捷的电泳平台进行分型。InDel 标记目前已开始应用于动植物群体遗传分析、分子辅助育种以及人类法医遗传学、医学诊断等领域。
InDel 产生主要与基因组的特征和 DNA 复制错误有关,还与转座子复制和插入、序列异常重组及不等交换等引物相关,大部分插入/缺失突变的产生机制现在仍然未知。InDel 在基因组中分布广泛、密度大、数目众多。就分布密度而言,Indel 仅次于 SNP,远高于 SSR,InDel 长度变化很大,平均长度为 36bp,最长可达 10000 bp,但 99%以上的 InDel 长度小于 50 bp。
拟南芥(Arabidopsis thaliana(L.)Heynh),属为十字花科、一年生细弱草本植物。又名鼠耳芥、阿拉伯芥、阿拉伯草,分布极其广泛。拟南芥作为遗传实验的材料的优点有:植株矮小,生长周期短,拟南芥繁殖能力强,每株植物可产生数千粒种子,闭花自花传粉,基因高度纯合,基因组简单,遗传操作更简便,因为被誉为“植物中的果蝇”。拟南芥因从不同的地点采集而被命名为不同的生态型。现在人们在世界各地共收集到 750 多个拟南芥生态型,这些生态型在形态发育、生理反应方面存在很大差异。在拟南芥的众多生态型中最常用的三种是 Landsberg erecta(Ler)、 Columbia(Col)和 Wassilewskija(Ws)。本实验选用 Col 和 Ler 两种生态型为亲本进行杂交,获得 F1,F1 自交后收获大量的 F2 代种子作为本实验的材料群体。我们拟通过一个 InDel 分子标记的 PCR 检测对 F2 群体的单株进行基因型鉴定,对拟南芥的该分子标记进行群体遗传学分析。
本实验选用的 Indel 分子标记位于 3 号染色体上,在生态型 Col 上有一个 121 bp 的插入序列,使用特异引物(位于插入位点上下游的单拷贝序列)扩增后,在 Col 和 Ler 两种生态型中的扩增条带大小分别为 511 bp 和 390 bp,序列信息示意图如下:
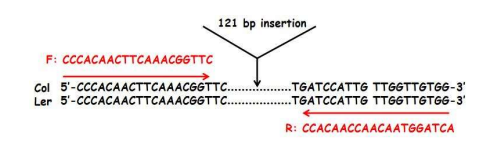
假定我们把该 InDel 标记在 Col 中的基因型定为 AA,则 Ler 中的基因型为 aa,它们杂交后的 F1 为 Aa,则 F2 自交群体中的基因型会出现 AA、Aa、aa 三种基因型,经 PCR 扩增和电泳分离检测后,以班级为单位统计 F2 群体的基因型,计算基因型频率,卡方检验是否符合预期分离比。
三、实验材料、仪器和试剂
实验材料:生长 8-10 天的拟南芥小苗(Col、Ler 及 F2 群体)
实验器材:1.5 mL EP 管、镊子、剪刀、马克笔、研磨棒,1 mL、200 μL 、20 μL、 2 μL
移液枪及对应枪头、1.5 ml 离心机、电泳仪、电泳槽、PCR 管、PCR 仪,天平,凝胶成像仪
实验试剂:Edward Buffer、异丙醇、70%乙醇、琼脂糖、1×TAE 电泳缓冲液、Taq 酶、ddH2O、
F/R 引物、 EB(溴化乙锭)或其他相应的染料
1LEdward Buffer 配方
试剂名称 |
质量/g |
Tris |
24.228 |
NaCl |
14.625 |
EDTA·2Na 9.3062
SDS(Sodium dodecyl sulfate) 5
ddH2O 调 PH=7.5,定容至 1 L
四、实验步骤
(一) 拟南芥 DNA 的提取(粗提)
1. 用镊子采集适量拟南芥样品放入标记好的 1.5 mL EP 管中。
2. 在 EP 管中加入 20 μL 的 Edward Buffer,用研磨棒将植物材料充分研磨成糊状,加入 400 μL Edward Buffer 后充分混匀,放入离心机中(注意要配平)12000 转离心
6 min。
3. 转移的上清液(约 380 μL)至新的 1.5 mL EP 管中,加入等体积的异丙醇(380 μL),上下颠倒离心管,充分混匀,室温静置 15~20 min。
4. 12000 转离心 6 min,弃上清(注意不要把沉淀倒出)。
5. 加入 600 μL 70%的乙醇,颠倒混匀,12000 转离心 2 min,弃上清液。
6. 重复步骤 5。
7. 用 200 μL 的移液器吸出 EP 管底部残留的液体(不要碰到沉淀)。随后放入 37℃ 烘箱干燥 15~20 分钟,直到底部的沉淀干燥不再有水渍。
8. 加入 60 μL ddH2O 溶解。4℃过夜后于-20℃保存备用。
(二) PCR 扩增
1. PCR 扩增体系为 15 μL
试剂 |
体积(μL) |
2×taq 酶 |
7.5 |
F 引物(forward primer) |
0.3 |
R 引物(reverse primer) |
0.3 |
模板(DNA) |
2 |
ddH2O 4.9
Total 15
注:引物序列:F 引物 CCCACAACTTCAAACGGTTC
R 引物 CCACAACCAACAATGGATCA
2. 实验准备时可将除 DNA 外的试剂配制成 Mix,每个样品分装 13 μL 的 Mix,各自加上
2 μL 的 DNA 样品,瞬时离心 2~3 s,将所有试剂沉入管底。
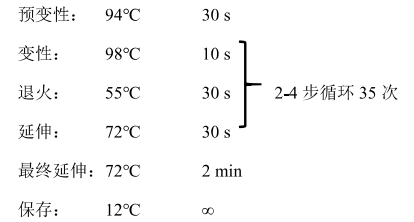
3. 将 PCR 管放入 PCR 仪中,按照如下程序进行扩增。
PCR 程序:
(三)PCR 扩增产物的琼脂糖凝胶电泳分离
用 1×TAE 配制 1.5-2%的琼脂糖凝胶。80-100 V 电压下电泳分离,20-30 min 后凝胶成像仪中拍照、记录电泳结果。
(五)实验结果
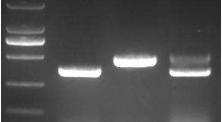
PCR 程序运行结束,取出管子,瞬时离心 3s,每个管中加入 2 μL 的 loading buffer(如用蓝酶扩增,则不需要再加入染料,可直接进行电泳检测),混匀,每个管取 10 μL 的 PCR 产物进行电泳分离(2%的琼脂糖凝胶,120 V 电泳 30 分钟),下图所示为两个亲本及 F1 的检测结果,F1 中因同时具有两种大小的模板,扩增的时候优先扩增较小的片段,所以 390 bp 的片段更亮一些。
M Col Ler F1
五、注意事项
1. PCR 各组分加入一个 PCR 管后不要忘记瞬时离心,PCR 程序结束后也要瞬时离心一下。
2. DNA 提取时严谨样品间混用枪头,避免样品间的污染,吸头不要长时间暴露于空气中,避免气溶胶的污染六、思考题
每个同学做两个样品(采集 2 株拟南芥小苗植物组织,如果植物稍大,一片真叶即可,如果植物较小,就用整个地上部分),以一个实验班为一个统计单位,分别记录三种基因型的个体的数据,进行卡方检验,检验是否符合预期的 1:2:1 的分离比,如果不符合,请分析可能的原因。
附录:拟南芥 Col 模板序列信息


0.4%的秋水仙素
2%的柠檬酸钠
甲醇:冰醋酸=3:1
0.075M KCl。
甲醇:冰乙酸=1:1
载玻片
盖玻片
卡宝品红
提前 2.5 小时注射秋水仙素
本周三晚上 18:30-22:30 :原双周三下午的班 余君萍(小鼠到的早就早点开始)
本周四上午 8:00-12:00 :原单周四上午的班 张科进
本周五下午 13:00-17:00 :原单周五下午的班 余君萍
本周五晚上 17:00-21:00 :原单周三下午的班 王玉华